
RESOLUCIÓN 24/2015
GRUPO MERCADO COMÚN (G.M.C.)
| |
Mecanismo de intercambio de información en el MERCOSUR sobre desvíos de calidad relacionados a ingredientes farmacéuticos activos (IFAs) y/o no cumplimiento de las Buenas Prácticas por empresas fabricantes, distribuidoras, importadoras y fraccionadoras de IFAs.
Del: 15/07/2015
|
|
VISTO: El Tratado de Asunción y el Protocolo de Ouro Preto.
CONSIDERANDO:
Que corresponde al ámbito de actuación de la vigilancia sanitaria monitorear desvíos de calidad relacionados con el no cumplimiento de las especificaciones de calidad de productos y/o con el no cumplimiento de Buenas Prácticas por parte de las empresas.
El impacto sobre la salud pública resultante de desvíos de calidad detectados en Ingredientes Farmacéuticos Activos (IFAs) y/o del no cumplimiento de Buenas Prácticas por parte de las empresas.
Que es necesario instrumentar un sistema de intercambio de información permanente entre los Estados Partes para que las autoridades sanitarias estén en condiciones de tomar las acciones necesarias para garantizar la calidad de los insumos farmacéuticos activos disponibles en el mercado.
EL GRUPO MERCADO COMÚN
RESUELVE:
|
Artículo 1- El “Mecanismo de intercambio de información en el MERCOSUR sobre desvíos de calidad relacionados a ingredientes farmacéuticos activos (IFAs) y/o no cumplimiento de las Buenas Prácticas por empresas fabricantes, distribuidoras, importadoras y fraccionadoras de IFAs” es el que consta como Anexo y forma parte de la presente Resolución.
Art. 2- Las Autoridades Sanitarias de los Estados Partes son los organismos nacionales competentes para la implementación de la presente Resolución.
Art. 3- Esta Resolución no necesita ser incorporada al ordenamiento jurídico de los Estados Partes, por reglamentar aspectos de la organización o del funcionamiento del MERCOSUR.
|
XLV GMC EXT.- Brasilia, 15/VII/15
|
ANEXO
MECANISMO DE INTERCAMBIO DE INFORMACIÓN EN EL MERCOSUR SOBRE DESVÍOS DE CALIDAD RELACIONADOS A INGREDIENTES FARMACÉUTICOS ACTIVOS (IFAs) Y/O NO CUMPLIMIENTO DE LAS BUENAS PRÁCTICAS POR EMPRESAS FABRICANTES, DISTRIBUIDORAS, IMPORTADORAS Y FRACCIONADORAS DE IFAs
1. Cada Estado Parte, a través de su Autoridad Sanitaria, deberá informar a los demás Estados Partes cuando reciba notificación o detecte desvíos que afectan la calidad de Ingredientes Farmacéuticos Activos (IFAs) relacionados al no cumplimiento de:
a. especificaciones de calidad para los IFAs; y/o
b. Buenas Prácticas por parte de las empresas.
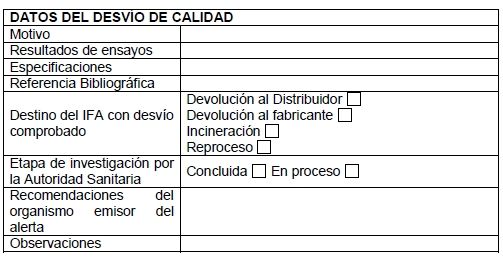
2. La comunicación a que hace referencia el punto 1 deberá ser realizada en el menor plazo posible, a través del formulario estandarizado que consta en el Apéndice.
3. El intercambio de informaciones será preferentemente virtual (por correo electrónico). La información deberá ser enviada preferentemente en un plazo máximo de setenta y dos (72) horas a partir de la confirmación del desvío.
4. Previamente a la confirmación del desvío, las Autoridades Sanitarias podrán comunicar sospechas de desvíos graves que aún se encuentren en investigación, considerando la dimensión de riesgo potencial.
5. A los efectos de esta Resolución se entenderá por:
5.1 CAS: Chemical Abstracts Service - Referencia Internacional de Sustancias Químicas.
5.2 DCI: Denominación Común Internacional - Denominación del fármaco o principio farmacológicamente activo aprobado por la Organización Mundial de la Salud - OMS.
5.3 Desvío de calidad: no cumplimiento de los parámetros de calidad para un producto o proceso.
5.4 Ingrediente Farmacéutico Activo (IFA): cualquier sustancia introducida en la formulación de una forma farmacéutica que, al ser administrada en un paciente, actúa como ingrediente activo. Las sustancias pueden ejercer actividad farmacológica u otro efecto directo en el diagnóstico, cura, tratamiento o prevención de una enfermedad, pudiendo afectar la estructura y funcionamiento del organismo humano. (Organización Mundial de la Salud - OMS)
5.5 Especificación: documento que describe en detalle los requisitos que deben cumplir los materiales utilizados durante la fabricación de los productos intermedios o productos terminados. Las especificaciones sirven como base para la evaluación de calidad.
5.6 Fabricante: empresa que realiza las operaciones y procesos necesarios para la obtención de Ingredientes Farmacéuticos Activos.
5.7 Distribuidor: empresa que realiza distribución de Ingredientes Farmacéuticos Activos.

|