
RESOLUCIÓN 1472/2011
MINISTERIO DE SALUD (M.S.)
| |
Apruébase el Proyecto Demostración para la incorporación de la Prueba de HPV como Tamizaje Primario.
Del: 12/09/2011; Boletín Oficial 26/09/2011.
|
|
VISTO el expediente Nº 2002-22108-10-9 del registro del MINISTERIO DE SALUD, y
CONSIDERANDO:
Que en el marco del PROGRAMA NACIONAL DE PREVENCION DE CANCER CERVICOUTERINO, este Ministerio, oportunamente, suscribió con la PROVINCIA DE JUJUY, un Acta Acuerdo para el fortalecimiento del PROGRAMA PROVINCIAL DE PREVENCION DE CANCER CERVICO-UTERINO en dicha jurisdicción considerada prioritaria.
Que en tal acuerdo, las partes previeron como uno de los objetivos específicos, para desarrollar conjuntamente, lograr la alta calidad de los servicios diagnósticos (toma y lectura de la citología).
Que el cáncer cérvico-uterino es la segunda causa de muerte por cáncer en mujeres entre TREINTA Y CINCO Y SESENTA Y CUATRO (35 y 64) años.
Que en la Argentina se diagnostican alrededor de TRES MIL (3000) casos nuevos por año de cáncer cérvico-uterino, muriendo DOS MIL (2000) mujeres por año por esta enfermedad.
Que existen limitaciones para reducir la incidencia y mortalidad por cáncer cérvicouterino, inherentes al tamizaje basado en la citología convencional (Prueba de Papanicolaou -Pap-).
Que estas limitaciones están generalmente asociadas a la baja cobertura de mujeres tamizadas, el bajo porcentaje de adhesión al seguimiento y tratamiento de lesiones, y a las dificultades operativas derivadas de la sensibilidad moderada de la prueba del Pap para la detección de lesiones de alto grado, que es de entre el CINCUENTA y SESENTA POR CIENTO (50% y 60%), y de su limitado valor predictivo negativo.
Que en Latinoamérica se están desarrollando con éxito experiencias de incorporación de nuevas tecnologías para el tamizaje, como la prueba de HPV-CH2.
Que a diferencia de la prueba del Pap, la prueba de HPV-CH2 tiene una sensibilidad mayor al NOVENTA Y CINCO POR CIENTO (95%) para la detección de lesiones de alto grado y un alto valor predictivo negativo.
Que la recomendación científica y de los organismos internacionales de salud pública, es la implementación de proyectos de demostración para cambiar los programas al nuevo paradigma de la prevención del cáncer cérvico-uterino basado en la prueba de HPV como tamizaje primario.
Que desde el MINISTERIO DE SALUD, resulta ineludible coordinar con las jurisdicciones provinciales, las acciones conducentes a la obtención de estrategias que optimicen la prevención del cáncer cérvico-uterino en el marco de programas organizados.
Que uno de los objetivos específicos del INSTITUTO NACIONAL DEL CANCER, es la implementación de estrategias de detección temprana promoviendo la inclusión de programas de prevención y control de dicha enfermedad en las diferentes jurisdicciones, con el objeto principal de disminuir la incidencia y mortalidad por cáncer.
Que la PROVINCIA DE JUJUY es una de las provincias con mayores tasas de mortalidad por cáncer cérvico-uterino.
Que la DIRECCION DE PROGRAMACION Y CONTROL PRESUPUESTARIO de la DIRECCION GENERAL DE ADMINISTRACION de la SECRETARIA DE COORDINACION de este Ministerio ha tomado la intervención que le compete.
Que la SUBSECRETARIA DE SALUD COMUNITARIA y la SECRETARIA DE PROMOCION Y PROGRAMAS SANITARIOS han tomado la intervención de su competencia y propician la aprobación del “PROYECTO PARA LA INCORPORACION DE LA PRUEBA DE HPV-CH2 COMO TAMIZAJE PRIMARIO”.
Que la DIRECCION GENERAL DE ASUNTOS JURIDICOS ha tomado la intervención de su competencia.
Que la presente medida se dicta en ejercicio de las facultades conferidas por la Ley de Ministerios - T.O. 1992, modificada por su similar Ley 26.338, y por el Artículo 2º del “Reglamento de Procedimientos Administrativos, Decreto 1759/72 t.o. 1991”.
Por ello,
El Ministro de Salud resuelve:
|
Artículo 1º.- Apruébase el “PROYECTO DEMOSTRACION PARA LA INCORPORACION DE LA PRUEBA DE HPV COMO TAMIZAJE PRIMARIO”, que como ANEXO I forma parte integrante de la presente medida, en el ámbito de la SUSBSECRETARIA DE SALUD COMUNITARIA de la SECRETARIA DE PROMOCION Y PROGRAMAS SANITARIOS del MINISTERIO DE SALUD, a fin de coordinar las acciones para desarrollar una estrategia de prevención basada en la prueba de HPV como método primario de tamizaje.
Art. 2º.- Apruébase el texto del convenio a suscribirse entre este Ministerio y la PROVINCIA DE JUJUY, para la puesta en marcha del Proyecto que se aprueba por el Artículo 1º, que como ANEXO II forma parte integrante de la presente resolución.
Art. 3º.- El “PROYECTO DEMOSTRACION PARA LA INCORPORACION DE LA PRUEBA HPV COMO TAMIZAJE PRIMARIO”, se ejecutará en forma articulada con el INSTITUTO NACIONAL DEL CANCER, organismo dependiente del MINISTERIO DE SALUD, referente nacional rector de las acciones en materia de cáncer, el que tendrá a su cargo la coordinación de las acciones que demande el cumplimiento de los objetivos del referido Proyecto.
Art. 4º.- El INSTITUTO NACIONAL DEL CANCER, en el ámbito de su competencia, deberá articular con la SUBSECRETARIA DE SALUD COMUNITARIA de la SECRETARIA DE PROMOCION Y PROGRAMAS SANITARIOS del MINISTERIO DE SALUD, las acciones que resulten necesarias a fin de contribuir al cumplimiento de los objetivos propuestos.
Art. 5º.- El “PROYECTO DEMOSTRACION PARA LA INCORPORACION DE LA PRUEBA DE HPV COMO TAMIZAJE PRIMARIO”, estará a cargo de UN (1) Director de Proyecto, que dependerá directamente de la SUBSECRETARIA DE SALUD COMUNITARIA de la SECRETARIA DE PROMOCION Y PROGRAMAS SANITARIOS de este Ministerio.
Art. 6º.- Autorízase a la SUBSECRETARIA DE SALUD COMUNITARIA de la SECRETARIA DE PROMOCION Y PROGRAMAS SANITARIOS de este Ministerio, a suscribir los convenios, documentos e instrumentos que resulten necesarios para la adecuada ejecución e implementación del Proyecto que se aprueba por el Artículo 1º de la presente Resolución.
Art. 7º.- Delégase en la SUBSECRETARIA DE SALUD COMUNITARIA de la SECRETARIA DE PROMOCION Y PROGRAMAS SANITARIOS de este Ministerio, la facultad de autorizar las transferencias de fondos a que hubiere lugar, imprescindibles para el correcto cumplimiento del “PROYECTO DEMOSTRACION PARA LA INCORPORACION DE LA PRUEBA DE HPV COMO TAMIZAJE PRIMARIO”, así como, la atribución de aprobar las rendiciones de cuentas del gasto de las transferencias que se efectúen.
Art. 8º.- Facúltase a la SECRETARIA DE PROMOCION Y PROGRAMAS SANITARIOS de este Ministerio a dictar las normas complementarias, interpretativas y aclaratorias de la presente Resolución.
Art. 9º.- El gasto que demande la ejecución efectiva del “PROYECTO PARA LA INCORPORACION DE LA PRUEBA DE HPV-CH2 COMO TAMIZAJE PRIMARIO”, será atendido con cargo a los créditos presupuestarios de la SUSBSECRETARIA DE SALUD COMUNITARIA de la Secretaría de Estado mencionada de este Ministerio.
Art. 10.- Regístrese, comuníquese, publíquese, dése a la Dirección Nacional del Registro Oficial a sus efectos y archívese.
ANEXO I
“Proyecto para la incorporación del la prueba de HPV-HC21 como tamizaje primario”
Presentado por la Coordinación de Detección Temprana del Instituto Nacional Del Cáncer y el Programa Nacional de Prevención de Cáncer Cérvico-uterino
Año 2011
FUNDAMENTACION
El cáncer cérvico-uterino es la segunda causa de muerte por cáncer en mujeres entre 35 y 64 años. En la Argentina se diagnostican alrededor de 3000 casos nuevos por año, y mueren 2000 mujeres por esta enfermedad.
Se ha comprobado que la causa necesaria del cáncer cérvico-uterino es la infección por el Virus Papiloma Humano (HPV), cuya principal vía de transmisión es la vía sexual (Bosch FX., 2002). Existe una asociación de más del 99% entre el HPV y el cáncer de cuello de útero (Castellsagué X., 2006).
Se han encontrado más de 100 tipos de HPV, de los cuales alrededor de 15 son considerados de alto riesgo oncogénico (los más comunes son el 16 y el 18, responsables de aproximadamente el 70% de los casos de cáncer cérvico-uterino, seguidos por el 31 y el 45).
A diferencia de los países desarrollados, los países latinoamericanos que han implementado programas organizados de prevención basados en la citología convencional se han encontrado con limitaciones para alcanzar el impacto deseado en la reducción de la incidencia y mortalidad. Las principales limitaciones se asocian con:
- la baja cobertura de mujeres tamizadas,
- el bajo porcentaje de mujeres con Pap anormal que son efectivamente seguidas y tratadas,
- la sensibilidad de la prueba que es entre moderada y baja, lo que obliga a repeticiones frecuentes del tamizaje para reducir el porcentaje de falsos positivos, y
- las numerosas instancias que pueden afectar la calidad de la lectura (toma, transporte, coloración, calidad de la muestra, etc.).
La sensibilidad de la prueba del Pap se estima entre el 50 y 60%. Esto resulta de la multiplicidad de instancias que deben asegurarse para la adecuada toma y lectura de la muestra. De hecho, el Pap es una prueba altamente operador-dependiente, sujeta a interpretaciones subjetivas, tanto en lo que refiere a quien toma la muestra como a quien la procesa.
En la siguiente tabla se resumen las ventajas de la prueba de HPV-HC2 en relación con la citología:
Tabla I: Cuadro comparativo. Características principales de la prueba de HPV-HC2 y la citología como métodos de tamizaje.
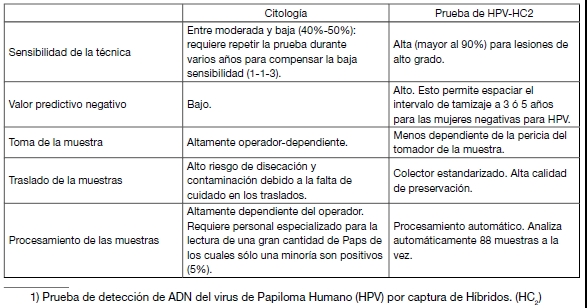
Para compensar estas deficiencias y asegurar la calidad de la citología, es necesaria la repetición de la prueba y la implementación de estrictos controles de calidad. Por ello, a pesar de los costos reducidos de los insumos, la citología no es necesariamente la opción más costo-efectiva para el tamizaje, en la medida que aumentan los costos y el número de veces que las mujeres deben concurrir a la consulta, con el riesgo de abandono que eso implica.
Estas dificultades en la implementación de programas de tamizaje basados en la citología en los países latinoamericanos, plantea la necesidad de un cambio de paradigma que incorpore los nuevos avances tecnológicos para la prevención del cáncer cérvico-uterino.
Tamizaje basado en la prueba de Virus del Papiloma Humano (Prueba de HPV)
A partir de la década del 90, se comenzó a desarrollar un método que permite detectar la presencia de ADN de HPV de alto riesgo oncogénico en las células del cuello del útero. Actualmente, existen en el mercado, aprobados por la FDA (Food And Drug Administration), tres pruebas para la detección de ADN de HPV en contextos de tamizaje poblacional. Sin embargo, la única prueba utilizada en los países de Latinoamérica que ya han iniciado experiencias de incorporación del la prueba de HPV como tamizaje primario es la prueba de HPV por captura de híbridos (HPV-HC2).
1) El test de HPV basado en la captura de híbridos es el único en el mundo para el cuál su efectividad para reducir la incidencia y mortalidad por cáncer de cuello de útero ha sido demostrada científicamente. En efecto, el único estudio publicado hasta el momento que se propuso medir el impacto de tres diferentes métodos de tamizaje en la reducción de la incidencia y mortalidad por cáncer cérvico-uterino fue realizado en India (Sankaranarayanan et al., 2009).
En dicho estudio se concluyó que las tasas de incidencia y mortalidad fueron significativamente mayores para los grupos que fueron tamizados con citología o Inspección Visual con ácido acético (VIA) que en el caso del grupo al que se le aplicó la prueba de HPV-HC2. El tamizaje mediante la prueba de HPV-HC2 contribuyó a alcanzar una reducción de casi el 50% en la tasa de mortalidad.
2) Existe amplia evidencia científica sobre la alta eficacia de la prueba de HPV-HC2 como método primario para la detección de lesiones de alto grado y cáncer (Tabla 1). No existe el mismo nivel de evidencia sobre la eficacia de las otras pruebas aprobadas por la FDA.
En la tabla 1 se presenta un listado de estudios que comparan la sensibilidad de la prueba de HPV-HC2 con la de la citología.
Tabla I: Sensibilidad relativa de la prueba de HPV-HC2 comparada con la citología en diferentes estudios. Años 1999 a 2004.
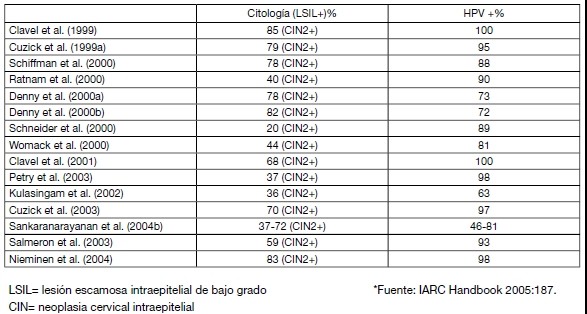
A su vez, un meta-análisis publicado en 2008 (Cuzick 2008) presenta una revisión de 31 estudios llevados a cabo entre los años 1995 y 2007 en diferentes países del mundo, que han evaluado la sensibilidad de la prueba de HPV-HC2 utilizado como método de tamizaje primario. En promedio, la sensibilidad de la prueba de HPV-HC2 fue del 89.7%. A continuación se presenta el listado de investigaciones revisadas entre los años 2005 y 2007:
- Agorasros T et al., 2005
- Bigras G et al., 2005
- Kotaniemi-Talonen L et al., 2005
- Sankaranarayanan R et al., 2005
- Sarian LO et al., 2005
- Ronco G et al., 2006
- Ronco G et al., 2006
- Almonte M et al., 2007
- Bulkmans NW et al., 2007
- Naucler P et al., 2007
- Mayrand MH et al., 2007
*Fuente: Cuzick, et al., 2008.
Existen también estudios en Latinoamérica que dan cuenta de esta ventaja de la prueba de HPV-HC2. Un estudio publicado en 2008 (Herrero et al., 2008) analiza diversos estudios de investigación sobre nuevas tecnologías aplicadas al tamizaje para la prevención del cáncer cérvico-uterino.
La siguiente tabla resume algunos de esos proyectos, destacando la sensibilidad obtenida para la prueba HPV-HC2 en cada caso.
Tabla II: Proyectos de Investigación en Latinoamérica sobre evaluación de la inclusión de nuevas tecnologías al tamizaje del cáncer cérvico-uterino.
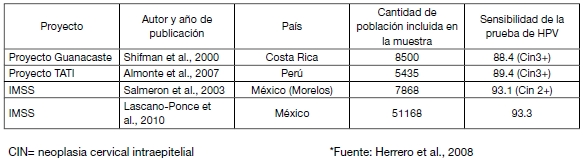
Programas de tamizaje basados en la prueba de HPV como tamizaje primario: el contexto latinoamericano Tomando en cuenta esta evidencia sobre la aplicación de nuevas tecnologías en los programas de tamizaje de cáncer cérvico-uterino, la OPS elaboró en 2008 una Estrategia Regional y Plan de Acción para la Prevención y Control del cáncer cérvico-uterino, que fue aprobada por los Ministros de Salud de América Latina durante el Consejo Directivo de la OPS de ese año. Como parte de esta estrategia, en junio de 2010 se llevó a cabo en Panamá el encuentro “Nuevas Tecnologías para la prevención del cáncer cérvico-uterino: de la evidencia científica a la planificación de programas”.
Las principales conclusiones del encuentro apuntan a que la implementación de estas nuevas tecnologías, respaldadas por evidencia científica clara y bien establecida, resulta factible. La Región se encuentra en un punto de inflexión en el que se reúnen las condiciones oportunas para lograr la incorporación de cambios en los programas que permitan lograr un impacto mayor en la reducción de las tasas de incidencia y mortalidad por esta enfermedad.
LA RECOMENDACION CIENTIFICA Y DE SALUD PUBLICA INTERNACIONAL ES LA IMPLEMENTACION DE PROYECTOS DE DEMOSTRACION PARA CAMBIAR LOS PROGRAMAS AL NUEVO PARADIGMA DE LA PREVENCION DEL CANCER CERVICO-UTERINO BASADO EN LA PRUEBA DE HPV-HC2 COMO TAMIZAJE PRIMARIO.
En algunos países latinoamericanos ya se han desarrollado experiencias de incorporación de la prueba de HPV-HC2 como método de tamizaje, buscando superar las limitaciones propias de la citología y contribuir a alcanzar la meta de reducción de la mortalidad. Es el caso de México, que desde el año 2007 ha establecido un esquema de tamizaje basado en la prueba de HPV-HC2 como tamizaje primario, seguido del Pap para las mujeres HPV positivas.
PROPUESTA DE INCORPORACION DE LA PRUEBA DE HPV-CH2 COMO TAMIZAJE PRIMARIO EN LA PROVINCIA DE JUJUY.
Se propone la implementación de un proyecto en la Provincia de Jujuy para incorporar la prueba de HPV-HC2 como tamizaje primario en mujeres entre 30 y 65 años, seguido de citología para aquellas mujeres con prueba de HPV positiva.
Se ha seleccionado la Provincia de Jujuy porque es una de las provincias con mayores tasas de mortalidad por cáncer cérvico-uterino, y tiene una capacidad organizativa del sistema de salud adecuada para la implementación del proyecto.
POBLACION OBJETIVO
Mujeres entre 30 y 65 años sin cobertura de salud de la provincia de Jujuy.
OBJETIVO GENERAL
Desarrollar una estrategia de prevención basada en la prueba de HPV-HC2 como método de tamizaje primario con el objetivo de reducir la incidencia y mortalidad por cáncer de cuello uterino en el país.
OBJETIVOS ESPECIFICOS
a) Implementar un proyecto de introducción de la prueba de HPV-HC2 en una provincia seleccionada.
b) Desarrollar, monitorear y evaluar los distintos componentes que deben articularse en un programa de prevención de cáncer cérvico-uterino basado en la prueba de HPV-HC2:
- b1) la estrategia de comunicación dirigida a la población y a los profesionales de la salud.
- b2) la estrategia de capacitación de los equipos de salud.
- b3) las estrategias de búsqueda activa de mujeres en edad objetivo.
- b4) la capacidad operativa del laboratorio de citología en el marco de una estrategia de doble toma (Prueba de HPV/citología): dispositivo de almacenamiento (espacio, tiempos), recursos humanos, identificación de muestras, carga de trabajo, etc.
- b5) un sistema de controles negativos de la prueba de HPV, que incluya la realización del Pap y colposcopia a una muestra de mujeres con prueba de HPV negativa.
- b6) un sistema de calidad para el seguimiento y tratamiento de las mujeres.
c) Evaluar en una muestra de mujeres la eficacia de la prueba de HPV-HC2 para detectar HSIL y cáncer en una población con alta mortalidad por cáncer cérvico-uterino.
d) Evaluar la aceptabilidad y la eficacia de la autotoma de la prueba de HPV-HC2 como estrategia para asegurar la cobertura del tamizaje.
e) Evaluar un algoritmo alternativo de seguimiento para las mujeres con prueba de HPV positiva y citología negativa.
METAS
Alcanzar un 80% de cobertura del tamizaje por medio de la prueba de HPV-HC2, en mujeres entre 30 y 65 años sin cobertura de salud.
Asegurar la calidad de la toma de la prueba de HPV-HC2 y su procesamiento en el laboratorio de HPV.
Lograr que el 100% de las mujeres con diagnóstico de HSIL+ accedan al tratamiento efectivo dentro de los 6 meses después del diagnóstico.
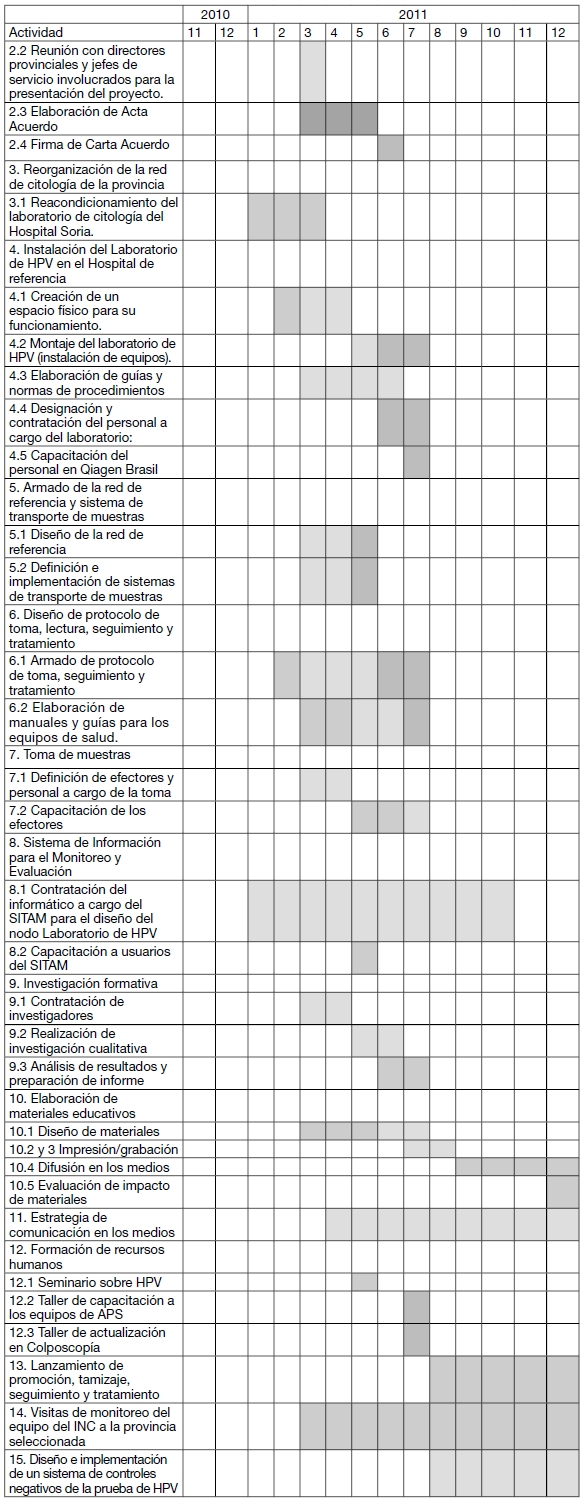
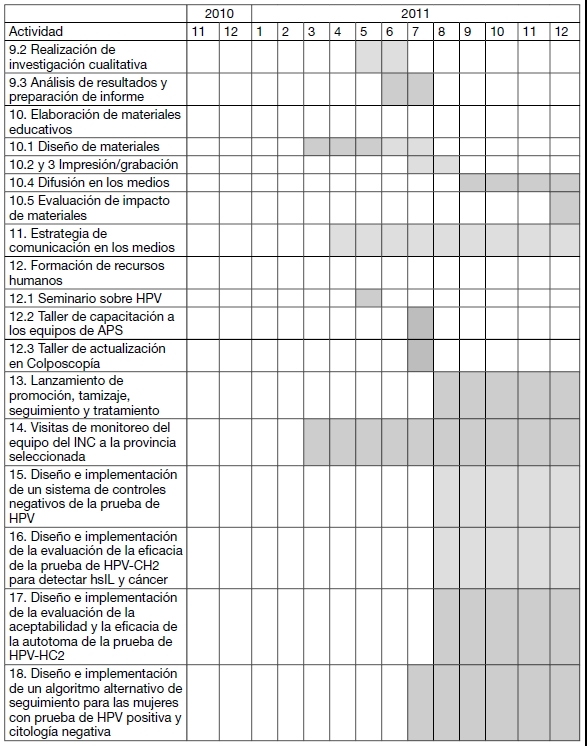
ACTIVIDADES
A. FIRMA DE CONTRATO CON EMPRESA PRODUCTORA (Qiagen)
1. CONSTITUCION DE CONSEJO ASESOR
Integrado por: Programa Nacional de Salud Sexual y Procreación Responsable, Sociedad Argentina de Citología, Sociedad de Ginecología de Buenos Aires, Sociedad Argentina del Tracto Genital Inferior y Colposcopía, Instituto Malbrán, Hospital de Clínicas San Martín, Organización Panamericana de la Salud, Fondo de Población de las Naciones Unidas, Centro de Estudios de Estado y Sociedad, Instituto Gino Germani, Consejo Nacional de la Mujer, Secretaría de Derechos Humanos, y expertos nacionales e internacionales invitados (Dr. Eduardo Lazcano-Ponce, Dr. Rolando Herrero, Dra. Lucrecia Illescas).
- Elaboración de Resolución de creación del Consejo Asesor.
2. FIRMA DE ACTA ACUERDO CON EL MINISTERIO DE SALUD DE LA PROVINCIA SELECCIONADA
- Reunión de presentación del proyecto con el Ministro de Salud de la Provincia seleccionada.
- Reunión de presentación del proyecto con directores provinciales y jefes de servicio involucrados en la implementación del proyecto.
- Elaboración de Acta Acuerdo: definición de compromisos del Ministerio de Salud de la Nación y del Ministerio de Salud de la Provincia.
- Firma de Acta Acuerdo.
3. REORGANIZACION DE LA RED DE LABORATORIOS DE CITOLOGIA DE LA PROVINCIA
- Reacondicionamiento del laboratorio de citología del Hospital Soria para el almacenamiento de las muestras citológicas de las mujeres entre 30 y 65 años (en el marco de la estrategia de doble toma -Prueba de HPV/citología-).
4. INSTALACION DEL LABORATORIO DE HPV EN EL HOSPITAL DE MAYOR COMPLEJIDAD DE LA PROVINCIA
- Creación de un espacio físico para su funcionamiento (requerimientos de espacio, teléfono, refrigeración y equipamiento).
- Montaje del laboratorio de HPV (instalación de equipos).
- Elaboración de guías y normas de procedimiento para el laboratorio y su articulación con el laboratorio de citología del Hospital.
- Designación y contratación del personal a cargo del laboratorio: Jefe de laboratorio, técnico de laboratorio, administrativo (a cargo del Ministerio de Salud Provincial).
- Capacitación del personal que estará a cargo del laboratorio: provista por Qiagen en Brasil (incluye vuelo, hotel, comida y transporte).
5. ARMADO DE LA RED DE REFERENCIA, DEFINICION DE SISTEMAS DE TRANSPORTE DE LAS MUESTRAS
- Diseño de la red de referencia.
- Definición e implementación de sistemas de transporte de muestras.
6. DISEÑO DEL PROTOCOLO DE TOMA, LECTURA, SEGUIMIENTO Y TRATAMIENTO DE MUJERES TAMIZADAS
- Armado de protocolo de toma, seguimiento y tratamiento.
- Elaboración de manuales y guías para los equipos de salud.
7. TOMA DE MUESTRAS.
- Definición de efectores y personal a cargo de la toma.
- Capacitación de los efectores a cargo de la toma sobre la toma de la muestra en un contexto de tamizaje basado en la prueba de HPV-HC2.
8. SISTEMA DE INFORMACION PARA EL MONITOREO Y EVALUACION
- Contratación del informático a cargo del SITAM para el diseño del nodo Laboratorio de HPV.
- Capacitación a usuarios del SITAM.
9. INVESTIGACION FORMATIVA PARA INDAGAR CONOCIMIENTOS Y PERCEPCIONES DE LA POBLACION SOBRE EL HPV (Grupos focales; Entrevistas cualitativas a equipos de salud)
- Contratación de investigadores.
- Realización de investigación cualitativa
- Análisis de resultados y preparación de informe.
10. ELABORACION DE MATERIALES EDUCATIVOS PARA LA POBLACION SOBRE EL TAMIZAJE BASADO EN LA PRUEBA DE HPV (folletos, afiches, spots radiales y televisivos).
- Diseño de materiales.
- Impresión/grabación.
- Difusión en los medios.
11. ELABORACION DE UNA ESTRATEGIA DE COMUNICACION EN MEDIOS
12. FORMACION DE RECURSOS HUMANOS
- Seminario sobre Epidemiología del HPV y cáncer de cuello de útero, y evidencia científica sobre estrategias de tamizaje basadas en la prueba de HPV-HC2:
Destinatarios: profesionales de la salud de la provincia: APS, servicios de ginecología, servicios de patología cervical, servicios de anatomía patológica, oncología.
Duración: 3-4 días.
Fecha: Semana del 16 de mayo 2011.
Financiamiento: Ministerio de Salud de la Nación/organismos internacionales.
Se ha solicitado apoyo a la UICC para el financiamiento de los invitados internacionales (Dr. Eduardo Lazcano-Ponce - México; Dr. Rolando Herrero - Costa Rica; Dr. R Rengaswamy Sankaranarayanan - Francia).
-Taller de capacitación a los equipos de APS.
-Taller de actualización en la técnica de la Colposcopía para servicios de ginecología.
- Capacitaciones específicas
13. LANZAMIENTO DE PROMOCION, TAMIZAJE, SEGUIMIENTO Y TRATAMIENTO
- Búsqueda activa de mujeres en edad objetivo para la realización de la prueba de HPV.
- Tamizaje de las mujeres en edad objetivo.
- Implementación del protocolo de seguimiento y tratamiento establecido
14. VISITAS DE MONITOREO A LA PROVINCIA
15. IMPLEMENTACION DE UN SISTEMA DE CONTROLES NEGATIVOS DE LA PRUEBA DE HPV
- Diseño e implementación del sistema de controles negativos.
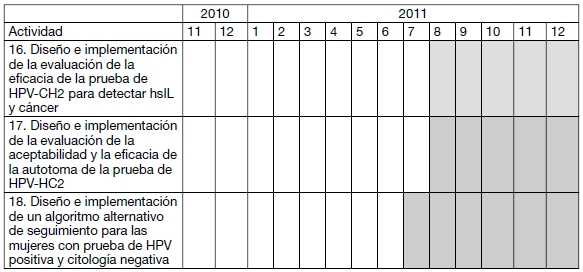
16. EVALUACION DE LA EFICACIA DE LA PRUEBA DE HPV-CH2 PARA DETECTAR HSIL Y CANCER
- Diseño e implementación del estudio.
17. EVALUAR LA ACEPTABILIDAD Y LA EFICACIA DE LA AUTOTOMA DE LA PRUEBA DE HPVHC2 COMO ESTRATEGIA PARA ASEGURAR LA COBERTURA DEL TAMIZAJE
- Diseño e implementación de la evaluación.
18. IMPLEMENTACION DE UN ALGORITMO ALTERNATIVO DE SEGUIMIENTO PARA LAS MUJERES CON PRUEBA DE HPV POSITIVA Y CITOLOGIA NEGATIVA
- Diseño e implementación del estudio
*Cálculo de población estimada a tamizar en la Provincia de Jujuy
Total mujeres entre 30 y 64 años sin obra social: 70.000
Cobertura estimada: 80%
Total mujeres a tamizar para alcanzar meta de cobertura en 3 años: 56.000
Total mujeres a tamizar por año: 20.000
Cantidad esperada de mujeres con HPV positivo: 1800 (9%)
Cantidad esperada de mujeres con HPV positivo y Pap negativo: 1400
Cantidad esperada de mujeres con HPV positivo y Pap positivo: 400 (2% del total mujeres)
Cantidad esperada de mujeres con HPV positivo y Pap positivo pero ASCUS o Bajo Grado: 229 mujeres
Cantidad esperada de mujeres con HPV positivo y HSIL +: 171 (43% de mujeres con HPV positivo y Pap positivo). Estas son las mujeres que luego de la confirmación histológica deberán ser tratadas.
Cantidad esperada de mujeres a seguir el año siguiente con repetición de la prueba de HPVHC2 y Pap: 1629.
Proporción esperada de mujeres con persistencia de HPV+: 40%, 650 mujeres a las que deberá hacerse una colposcopía y biopsia. De estas mujeres, se espera que un 15% tengan hsIL+, es decir, aproximadamente 100 mujeres que deberán tratarse en el año 2 y 3. En total, en el año 2, deberán tratarse 271 mujeres con HSIL+.
Fuente: Lazcano-Ponce et al, 2010.
CRONOGRAMA DE ACTIVIDADES PARA EL PRIMER AÑO
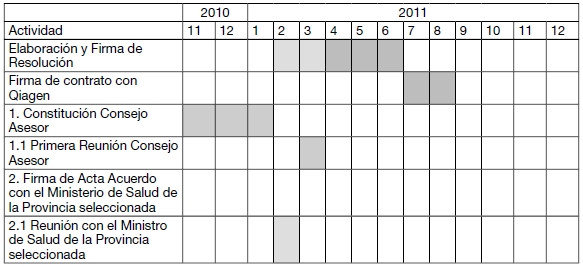
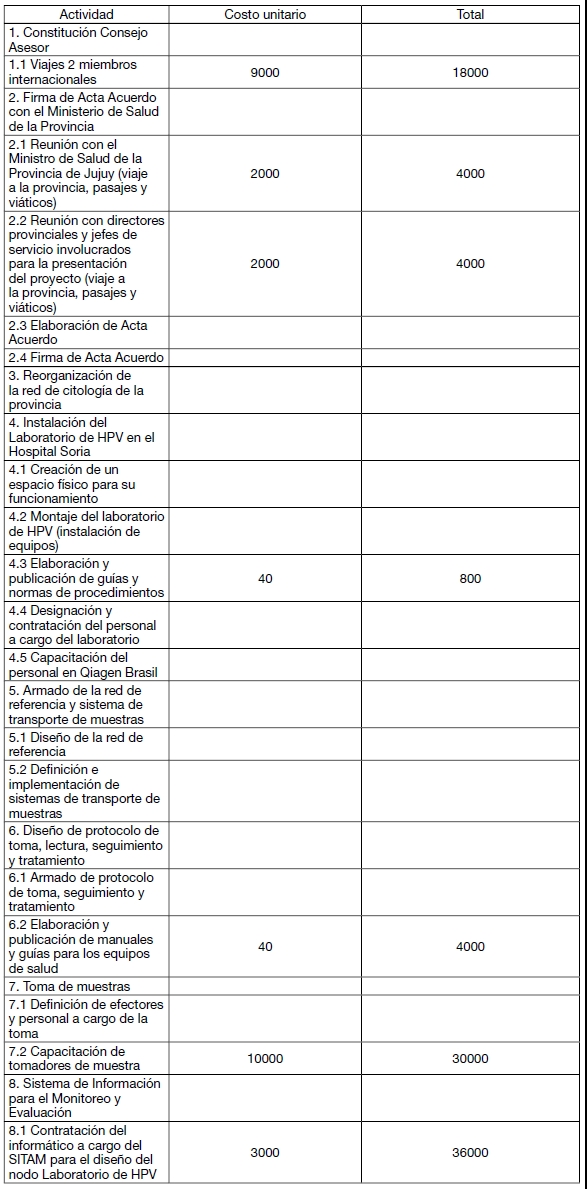
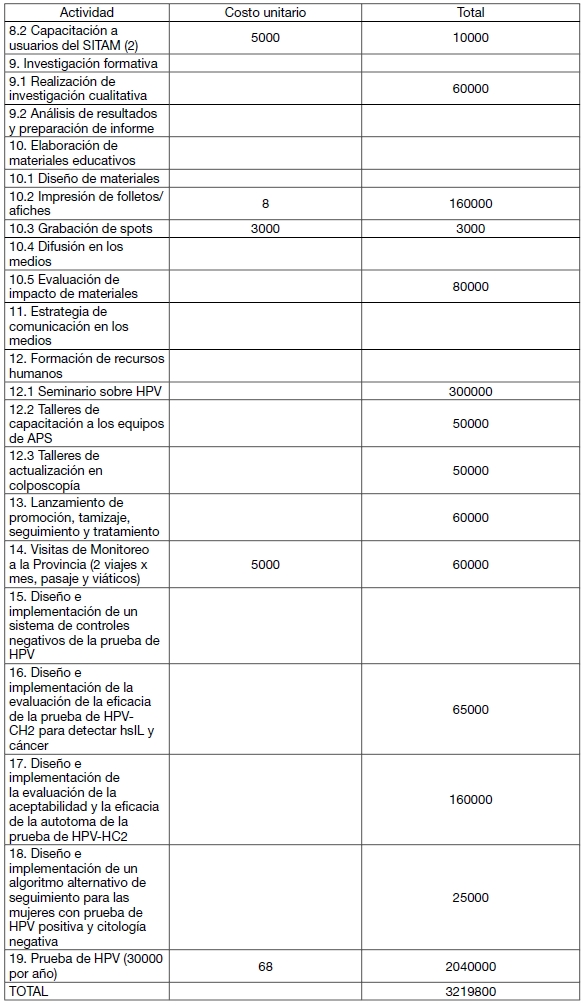
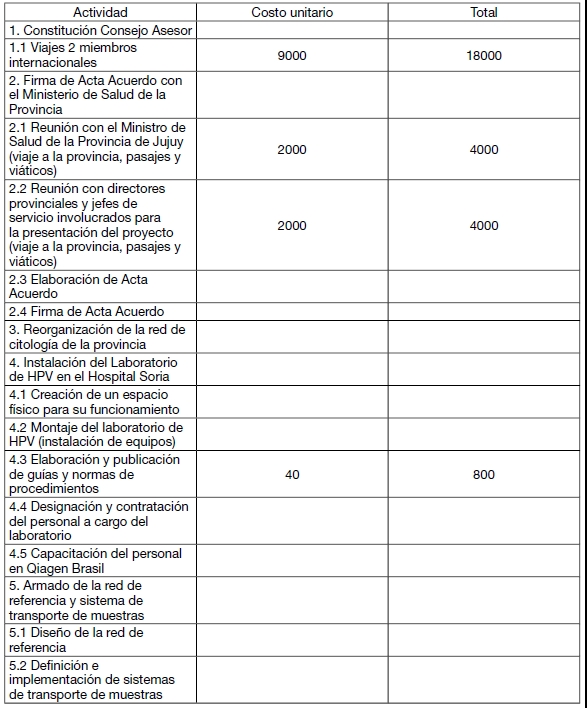
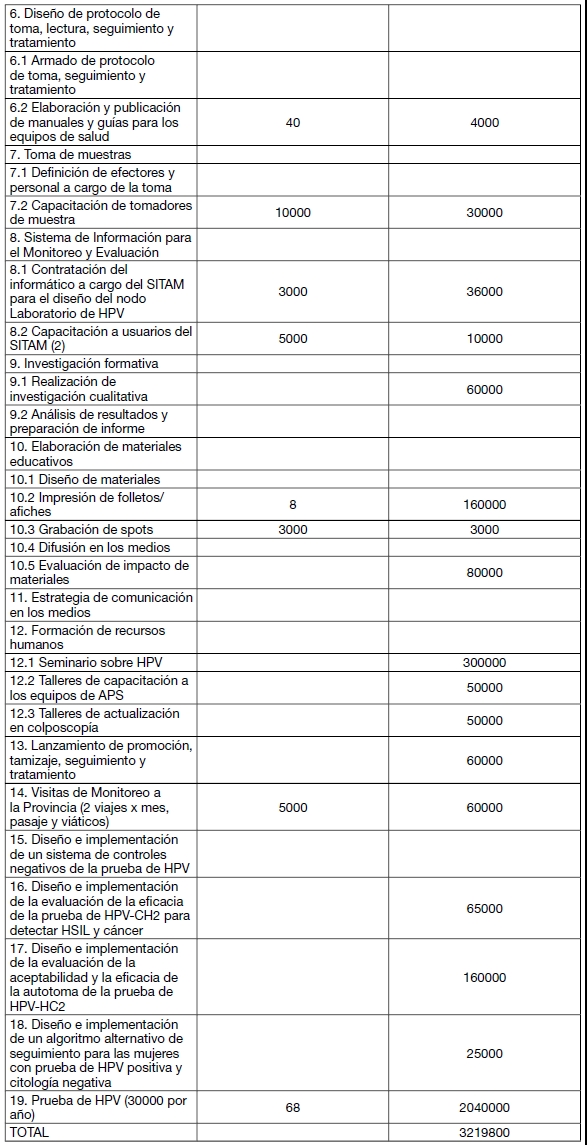
PRESUPUESTO ESTIMADO
ANEXO II
CONVENIO ESPECIFICIO
MINISTERIO DE SALUD DE LA NACION - PROVINCIA DE JUJUY
PROGRAMA NACIONAL DE PREVENCION DE CANCER CERVICO-UTERINO
INSTITUTO NACIONAL DEL CANCER
“PROYECTO PARA LA INCORPORACION DE LA PRUEBA DE HPV-HC2 COMO TAMIZAJE PRIMARIO”
Entre el ESTADO NACIONAL - MINISTERIO DE SALUD, representado en este acto por el Subsecretario de Salud Comunitaria del MINISTERIO DE SALUD DE LA NACION, doctor Guillermo González Prieto, con domicilio en Av. 9 de Julio 1925 de la Ciudad Autónoma de Buenos Aires, en adelante “EL MINISTERIO”; y por la otra, EL MINISTERIO DE SALUD DE LA PROVINCIA DE JUJUY, representado por el Ministro de Salud, doctor Víctor Alberto Urbani, con domicilio en San Martín 61 de la Ciudad de San Salvador de Jujuy, Provincia de Jujuy, en adelante “LA PROVINCIA”, DECLARAN lo siguiente:
1º) Que con fecha 22/10/2008 en el marco del Programa Nacional de Prevención de Cáncer Cérvico-Uterino, ambas partes suscribieron una Carta Acuerdo para el fortalecimiento del Programa de Prevención de Cáncer Cérvico-uterino de “LA PROVINCIA”.
2º) Que de acuerdo con el Artículo SEGUNDO de dicha Carta Acuerdo, ambas partes previeron como uno de los objetivos específicos para desarrollar conjuntamente, lograr la alta calidad de los servicios diagnósticos (toma y lectura de la citología).
3º) Que a los fines de la consecución de la finalidad y objetivos específicos establecidos en el Acuerdo mencionado, “EL MINISTERIO” y “LA PROVINCIA” asumieron las obligaciones previstas en los Artículos TERCERO y CUARTO, respectivamente.
Y por ello, en el marco de la Carta Acuerdo de fecha 22/10/2008 ambas partes ACUERDAN en celebrar el presente Convenio Específico de cooperación para el fortalecimiento del Programa Provincial de Prevención de Cáncer Cérvico-Uterino, el que se regirá de acuerdo a las siguientes cláusulas y condiciones:
PRIMERA: FINALIDAD
El presente convenio tiene como propósito establecer los términos y condiciones bajo los cuales el “EL MINISTERIO” y “LA PROVINCIA”, trabajarán en conjunto para la implementación del Proyecto de Incorporación de la prueba de detección de ADN del virus de Papiloma Humano (prueba de HPV-CH2) como tamizaje primario, cuyos fundamentos y descripción se detallan en el Anexo I del presente acuerdo, el cual forma parte integrante del mismo.
SEGUNDA: OBJETIVOS
Las partes declaran el siguiente objetivo para desarrollar conjuntamente: Desarrollar una estrategia de prevención basada en la prueba de HPV-HC2 como método de tamizaje primario con el objetivo de reducir la incidencia y mortalidad por cáncer de cuello uterino en la provincia de Jujuy.
TERCERA: OBLIGACIONES DE “EL MINISTERIO”
De conformidad con sus reglas, reglamentos, políticas y procedimientos, EL MINISTERIO, a los fines del cumplimiento de los objetivos establecido en la cláusula PRIMERA, se compromete a:
1. Proveer a LA PROVINCIA los insumos para la toma de las pruebas de HPV-CH2, así como el equipamiento necesario para la instalación del laboratorio de HPV, según se especifica en el Anexo II del presente convenio.
2. Capacitar a los equipos de salud de la provincia involucrados en el desarrollo del proyecto, a saber:
- capacitación para los profesionales del Laboratorio de HPV
- capacitación para la toma del test de HPV
- capacitación para la búsqueda activa de mujeres
- formación científica sobre epidemiología del HPV y nuevas tecnologías en prevención de cáncer cérvico-uterino.
3. Proveer materiales de comunicación destinados a la promoción del tamizaje con el test de HPV en la población objetivo.
4. Brindar asistencia técnica continua al Programa Provincial de Prevención de Cáncer Cérvicouterino y a los efectores y servicios involucrados en la implementación del Proyecto.
CUARTA: OBLIGACIONES DE “LA PROVINCIA”
De conformidad con sus reglas, reglamentos, políticas y procedimientos, LA PROVINCIA, a los fines del cumplimiento de los objetivos establecido en la cláusula PRIMERA del presente convenio, se compromete a:
1. Instalar el Laboratorio de HPV en el Hospital Soria, adecuar el espacio físico e instalar el equipamiento provisto por EL MINISTERIO.
2. Contratar un profesional capacitado para dirigir el Laboratorio de HPV, que dependerá del Jefe del Laboratorio de Anatomía Patológica del Hospital Pablo Soria.
3. Asegurar el adecuado funcionamiento de todos los componentes de la prevención del cáncer cérvico-uterino. A tal efecto, deberá:
- implementar estrategias de búsqueda activa para la realización del test de HPV en la población objetivo.
- asegurar la toma de la muestra en la población objetivo.
- implementar un adecuado mecanismo de traslado de las muestras.
- asegurar la calidad en el procesamiento de las muestras en el laboratorio de HPV.
- asegurar el adecuado seguimiento y tratamiento de mujeres con diagnóstico anormal.
QUINTA: RESPONSABLES DEL PROYECTO
La coordinación de la ejecución del presente convenio estará a cargo de las siguientes personas:
a) Por “EL MINISTERIO”: la Coordinadora Científica del Programa Nacional de Prevención de Cáncer Cérvico-uterino y la Coordinadora del Area de Detección Temprana del INSTITUTO NACIONAL DEL CANCER.
b) Por “LA PROVINCIA”: la Coordinadora del Programa Provincial de Prevención de Cáncer Cérvico- uterino.
SEXTA: INFORMES
“LA PROVINCIA” preparará y presentará a “EL MINISTERIO” un informe trimestral del desarrollo de Proyecto. “EL MINISTERIO” por medio de la SUBSECRETARIA DE SALUD COMUNITARIA y el INSTITUTO NACIONAL DEL CANCER, se reservan el derecho de solicitar a “LA PROVINCIA” la ampliación de la información suministrada.
SEPTIMA: CONTROL DE GESTION
“EL MINISTERIO”, a través de la Subsecretaría de Salud Comunitaria y el INSTITUTO NACIONAL DEL CANCER, sin perjuicio de la auditoría que realice la Unidad de Auditoria Interna de “EL MINISTERIO” en el ámbito de su competencia, se encuentran facultados a efectuar el seguimiento y evaluación de la ejecución de la ejecución del presente convenio. A tal efecto, cada vez que lo consideren oportuno, podrán disponer el traslado de personal especializado al ámbito provincial, a fin de realizar las verificaciones y/o análisis de gestión que estimen conducentes sobre el cumplimiento del presente acuerdo.
“La PROVINCIA” se compromete a poner a disposición de “EL MINISTERIO” todos los elementos de juicio, documentación respaldatoria, personal de apoyo, vehículos de transporte y todo instrumento que resulten necesarios para las evaluaciones que se efectúen en el ámbito provincial.
Provincial de Prevención de Cáncer Cérvico-Uterino, el que se regirá de acuerdo a las siguientes cláusulas y condiciones:
PRIMERA: FINALIDAD
El presente convenio tiene como propósito establecer los términos y condiciones bajo los cuales el “EL MINISTERIO” y “LA PROVINCIA”, trabajarán en conjunto para la implementación del Proyecto de Incorporación de la prueba de detección de ADN del virus de Papiloma Humano (prueba de HPV-CH2) como tamizaje primario, cuyos fundamentos y descripción se detallan en el Anexo I del presente acuerdo, el cual forma parte integrante del mismo.
SEGUNDA: OBJETIVOS
Las partes declaran el siguiente objetivo para desarrollar conjuntamente: Desarrollar una estrategia de prevención basada en la prueba de HPV-HC2 como método de tamizaje primario con el objetivo de reducir la incidencia y mortalidad por cáncer de cuello uterino en la provincia de Jujuy.
TERCERA: OBLIGACIONES DE “EL MINISTERIO”
De conformidad con sus reglas, reglamentos, políticas y procedimientos, EL MINISTERIO, a los fines del cumplimiento de los objetivos establecido en la cláusula PRIMERA, se compromete a:
1. Proveer a LA PROVINCIA los insumos para la toma de las pruebas de HPV-CH2, así como el equipamiento necesario para la instalación del laboratorio de HPV, según se especifica en el Anexo II del presente convenio.
2. Capacitar a los equipos de salud de la provincia involucrados en el desarrollo del proyecto, a saber:
- capacitación para los profesionales del Laboratorio de HPV
- capacitación para la toma del test de HPV
- capacitación para la búsqueda activa de mujeres
- formación científica sobre epidemiología del HPV y nuevas tecnologías en prevención de cáncer cérvico-uterino.
3. Proveer materiales de comunicación destinados a la promoción del tamizaje con el test de HPV en la población objetivo.
4. Brindar asistencia técnica continua al Programa Provincial de Prevención de Cáncer Cérvicouterino y a los efectores y servicios involucrados en la implementación del Proyecto.
CUARTA: OBLIGACIONES DE “LA PROVINCIA”
De conformidad con sus reglas, reglamentos, políticas y procedimientos, LA PROVINCIA, a los fines del cumplimiento de los objetivos establecido en la cláusula PRIMERA del presente convenio, se compromete a:
1. Instalar el Laboratorio de HPV en el Hospital Soria, adecuar el espacio físico e instalar el equipamiento provisto por EL MINISTERIO.
2. Contratar un profesional capacitado para dirigir el Laboratorio de HPV, que dependerá del Jefe del Laboratorio de Anatomía Patológica del Hospital Pablo Soria.
3. Asegurar el adecuado funcionamiento de todos los componentes de la prevención del cáncer cérvico-uterino. A tal efecto, deberá:
- implementar estrategias de búsqueda activa para la realización del test de HPV en la población objetivo.
- asegurar la toma de la muestra en la población objetivo.
- implementar un adecuado mecanismo de traslado de las muestras.
- asegurar la calidad en el procesamiento de las muestras en el laboratorio de HPV.
- asegurar el adecuado seguimiento y tratamiento de mujeres con diagnóstico anormal.
QUINTA: RESPONSABLES DEL PROYECTO
La coordinación de la ejecución del presente convenio estará a cargo de las siguientes personas:
a) Por “EL MINISTERIO”: la Coordinadora Científica del Programa Nacional de Prevención de Cáncer Cérvico-uterino y la Coordinadora del Area de Detección Temprana del INSTITUTO NACIONAL DEL CANCER.
b) Por “LA PROVINCIA”: la Coordinadora del Programa Provincial de Prevención de Cáncer Cérvico- uterino.
SEXTA: INFORMES
“LA PROVINCIA” preparará y presentará a “EL MINISTERIO” un informe trimestral del desarrollo de Proyecto. “EL MINISTERIO” por medio de la SUBSECRETARIA DE SALUD COMUNITARIA y el INSTITUTO NACIONAL DEL CANCER, se reservan el derecho de solicitar a “LA PROVINCIA” la ampliación de la información suministrada.
SEPTIMA: CONTROL DE GESTION
“EL MINISTERIO”, a través de la Subsecretaría de Salud Comunitaria y el INSTITUTO NACIONAL DEL CANCER, sin perjuicio de la auditoría que realice la Unidad de Auditoria Interna de “EL MINISTERIO” en el ámbito de su competencia, se encuentran facultados a efectuar el seguimiento y evaluación de la ejecución de la ejecución del presente convenio. A tal efecto, cada vez que lo consideren oportuno, podrán disponer el traslado de personal especializado al ámbito provincial, a fin de realizar las verificaciones y/o análisis de gestión que estimen conducentes sobre el cumplimiento del presente acuerdo.
“La PROVINCIA” se compromete a poner a disposición de “EL MINISTERIO” todos los elementos de juicio, documentación respaldatoria, personal de apoyo, vehículos de transporte y todo instrumento que resulten necesarios para las evaluaciones que se efectúen en el ámbito provincial.
A diferencia de los países desarrollados, los países latinoamericanos que han implementado programas organizados de prevención basados en la citología convencional se han encontrado con limitaciones para alcanzar el impacto deseado en la reducción de la incidencia y mortalidad. Las principales limitaciones se asocian con:
- la baja cobertura de mujeres tamizadas,
- el bajo porcentaje de mujeres con Pap anormal que son efectivamente seguidas y tratadas,
- la sensibilidad de la prueba que es entre moderada y baja, lo que obliga a repeticiones frecuentes del tamizaje para reducir el porcentaje de falsos positivos, y
- las numerosas instancias que pueden afectar la calidad de la lectura (toma, transporte, coloración, calidad de la muestra, etc.).
La sensibilidad de la prueba del Pap se estima entre el 50 y 60%. Esto resulta de la multiplicidad de instancias que deben asegurarse para la adecuada toma y lectura de la muestra. De hecho, el Pap es una prueba altamente operador-dependiente, sujeta a interpretaciones subjetivas, tanto en lo que refiere a quien toma la muestra como a quien la procesa.
En la siguiente tabla se resumen las ventajas de la prueba de HPV-HC2 en relación con la citología:
Tabla I: Cuadro comparativo. Características principales de la prueba de HPV-HC2 y la citología como métodos de tamizaje.
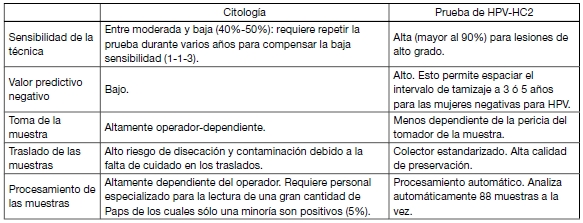
Para compensar estas deficiencias y asegurar la calidad de la citología, es necesaria la repetición de la prueba y la implementación de estrictos controles de calidad. Por ello, a pesar de los costos reducidos de los insumos, la citología no es necesariamente la opción más costo-efectiva para el tamizaje, en la medida que aumentan los costos y el número de veces que las mujeres deben concurrir a la consulta, con el riesgo de abandono que eso implica.
Estas dificultades en la implementación de programas de tamizaje basados en la citología en los países latinoamericanos, plantea la necesidad de un cambio de paradigma que incorpore los nuevos avances tecnológicos para la prevención del cáncer cérvico-uterino.
Tamizaje basado en la prueba de Virus del Papiloma Humano (Prueba de HPV)
A partir de la década del 90, se comenzó a desarrollar un método que permite detectar la presencia de ADN de HPV de alto riesgo oncogénico en las células del cuello del útero. Actualmente, existen en el mercado, aprobados por la FDA (Food And Drug Administration), tres pruebas para la detección de ADN de HPV en contextos de tamizaje poblacional. Sin embargo, la única prueba utilizada en los países de Latinoamérica que ya han iniciado experiencias de incorporación de la prueba de HPV como tamizaje primario es la prueba de HPV por captura de híbridos (HPV-HC2).
1) El test de HPV basado en la captura de híbridos es el único en el mundo para el cual su efectividad para reducir la incidencia y mortalidad por cáncer de cuello de útero ha sido demostrada científicamente. En efecto, el único estudio publicado hasta el momento que se propuso medir el impacto de tres diferentes métodos de tamizaje en la reducción de la incidencia y mortalidad por cáncer cérvico-uterino fue realizado en India (Sankaranarayanan et al., 2009). En dicho estudio se concluyó que las tasas de incidencia y mortalidad fueron significativamente mayores para los grupos que fueron tamizados con citología o Inspección Visual con ácido acético (VIA) que en el caso del grupo al que se le aplicó la prueba de HPV-HC2. El tamizaje mediante la prueba de HPV-HC2 contribuyó a alcanzar una reducción de casi el 50% en la tasa de mortalidad.
2) Existe amplia evidencia científica sobre la alta eficacia de la prueba de HPV-HC2 como método primario para la detección de lesiones de alto grado y cáncer (Tabla 1). No existe el mismo nivel de evidencia sobre la eficacia de las otras pruebas aprobadas por la FDA.
En la tabla 1 se presenta un listado de estudios que comparan la sensibilidad de la prueba de HPV-HC2 con la de la citología.
Tabla I: Sensibilidad relativa de la prueba de HPV-HC2 comparada con la citología en diferentes estudios. Años 1999 a 2004.
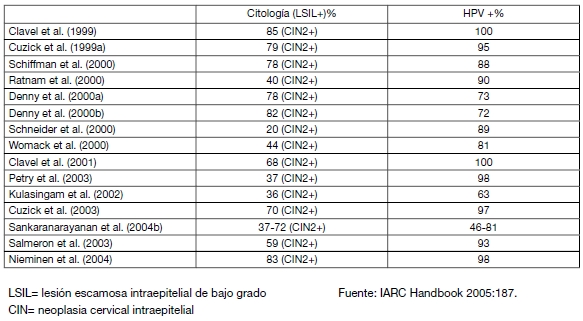
A su vez, un meta-análisis publicado en 2008 (Cuzick 2008) presenta una revisión de 31 estudios llevados a cabo entre los años 1995 y 2007 en diferentes países del mundo, que han evaluado la sensibilidad de la prueba de HPV-HC2 utilizado como método de tamizaje primario. En promedio, la sensibilidad de la prueba de HPV-HC2 fue del 89.7%. A continuación se presenta el listado de investigaciones revisadas entre los años 2005 y 2007:
- Agorasros T et al., 2005
- Bigras G et al., 2005
- Kotaniemi-Talonen L et al., 2005
- Sankaranarayanan R et al., 2005
- Sarian LO et al., 2005
- Ronco G et al., 2006
- Ronco G et al., 2006
- Almonte M et al., 2007
- Bulkmans NW et al., 2007
- Naucler P et al., 2007
- Mayrand MH et al., 2007
*Fuente: Cuzick, et al., 2008.
Existen también estudios en Latinoamérica que dan cuenta de esta ventaja de la prueba de HPV-HC2. Un estudio publicado en 2008 (Herrero et al., 2008) analiza diversos estudios de investigación sobre nuevas tecnologías aplicadas al tamizaje para la prevención del cáncer cérvico-uterino.
La siguiente tabla resume algunos de esos proyectos, destacando la sensibilidad obtenida para la prueba HPV-HC2 en cada caso.
Tabla II: Proyectos de Investigación en Latinoamérica sobre evaluación de la inclusión de nuevas tecnologías al tamizaje del cáncer cérvico-uterino.
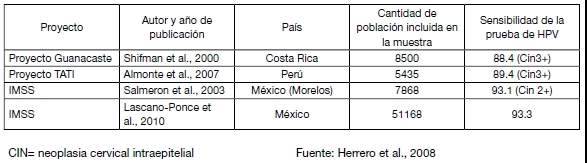
Programas de tamizaje basados en la prueba de HPV como tamizaje primario: el contexto latinoamericano
Tomando en cuenta esta evidencia sobre la aplicación de nuevas tecnologías en los programas de tamizaje de cáncer cérvico-uterino, la OPS elaboró en 2008 una Estrategia Regional y Plan de Acción para la Prevención y Control del cáncer cérvico-uterino, que fue aprobada por los Ministros de Salud de América Latina durante el Consejo Directivo de la OPS de ese año. Como parte de esta estrategia, en junio de 2010 se llevó a cabo en Panamá el encuentro “Nuevas Tecnologías para la prevención del cáncer cérvico-uterino: de la evidencia científica a la planificación de programas”.
Las principales conclusiones del encuentro apuntan a que la implementación de estas nuevas tecnologías, respaldadas por evidencia científica clara y bien establecida, resulta factible. La Región se encuentra en un punto de inflexión en el que se reúnen las condiciones oportunas para lograr la incorporación de cambios en los programas que permitan lograr un impacto mayor en la reducción de las tasas de incidencia y mortalidad por esta enfermedad.
LA RECOMENDACION CIENTIFICA Y DE SALUD PUBLICA INTERNACIONAL ES LA IMPLEMENTACION DE PROYECTOS DE DEMOSTRACION PARA CAMBIAR LOS PROGRAMAS AL NUEVO PARADIGMA DE LA PREVENCION DEL CANCER CERVICO-UTERINO BASADO EN LA PRUEBA DE HPV-HC2 COMO TAMIZAJE PRIMARIO.
En algunos países latinoamericanos ya se han desarrollado experiencias de incorporación de la prueba de HPV-HC2 como método de tamizaje, buscando superar las limitaciones propias de la citología y contribuir a alcanzar la meta de reducción de la mortalidad. Es el caso de México, que desde el año 2007 ha establecido un esquema de tamizaje basado en la prueba de HPV-HC2 como tamizaje primario, seguido del Pap para las mujeres HPV positivas.
PROPUESTA DE INCORPORACION DE LA PRUEBA DE HPV-CH2 COMO TAMIZAJE PRIMARIO EN LA PROVINCIA DE JUJUY.
Se propone la implementación de un proyecto en la Provincia de Jujuy para incorporar la prueba de HPV-HC2 como tamizaje primario en mujeres entre 30 y 65 años, seguido de citología para aquellas mujeres con prueba de HPV positiva.
Se ha seleccionado la Provincia de Jujuy porque es una de las provincias con mayores tasas de mortalidad por cáncer cérvico-uterino, y tiene una capacidad organizativa del sistema de salud adecuada para la implementación del proyecto.
POBLACION OBJETIVO
Mujeres entre 30 y 65 años sin cobertura de salud de la provincia de Jujuy.
OBJETIVO GENERAL
Desarrollar una estrategia de prevención basada en la prueba de HPV-HC2 como método de tamizaje primario con el objetivo de reducir la incidencia y mortalidad por cáncer de cuello uterino en el país.
OBJETIVOS ESPECIFICOS
a) Implementar un proyecto de introducción de la prueba de HPV-HC2 en una provincia seleccionada.
b) Desarrollar, monitorear y evaluar los distintos componentes que deben articularse en un programa de prevención de cáncer cérvico-uterino basado en la prueba de HPV-HC2:
- b1) la estrategia de comunicación dirigida a la población y a los profesionales de la salud.
- b2) la estrategia de capacitación de los equipos de salud.
- b3) las estrategias de búsqueda activa de mujeres en edad objetivo.
- b4) la capacidad operativa del laboratorio de citología en el marco de una estrategia de doble toma (Prueba de HPV / citología): dispositivo de almacenamiento (espacio, tiempos), recursos humanos, identificación de muestras, carga de trabajo, etc.
-b5) un sistema de controles negativos de la prueba de HPV, que incluya la realización del Pap y colposcopía a una muestra de mujeres con prueba de HPV negativa.
- b6) un sistema de calidad para el seguimiento y tratamiento de las mujeres.
c) Evaluar en una muestra de mujeres la eficacia de la prueba de HPV-HC2 para detectar HSIL y cáncer en una población con alta mortalidad por cáncer cérvico-uterino.
d) Evaluar la aceptabilidad y la eficacia de la autotoma de la prueba de HPV-HC2 como estrategia para asegurar la cobertura del tamizaje.
e) Evaluar un algoritmo alternativo de seguimiento para las mujeres con prueba de HPV positiva y citología negativa.
METAS
Alcanzar un 80% de cobertura del tamizaje por medio de la prueba de HPV-HC2, en mujeres entre 30 y 65 años sin cobertura de salud.
Asegurar la calidad de la toma de la prueba de HPV-HC2 y su procesamiento en el laboratorio de HPV.
Lograr que el 100% de las mujeres con diagnóstico de HSIL+ accedan al tratamiento efectivo dentro de los 6 meses después del diagnóstico.
ACTIVIDADES
A. FIRMA DE CONTRATO CON EMPRESA PRODUCTORA (Qiagen)
1. CONSTITUCION DE CONSEJO ASESOR
Integrado por: Programa Nacional de Salud Sexual y Procreación Responsable, Sociedad Argentina de Citología, Sociedad de Ginecología de Buenos Aires, Sociedad Argentina del Tracto Genital Inferior y Colposcopía, Instituto Malbrán, Hospital de Clínicas San Martín, Organización Panamericana de la Salud, Fondo de Población de las Naciones Unidas, Centro de Estudios de Estado y Sociedad, Instituto Gino Germani, Consejo Nacional de la Mujer, Secretaría de Derechos Humanos, y expertos nacionales e internacionales invitados (Dr. Eduardo Lazcano-Ponce, Dr. Rolando Herrero, Dra. Lucrecia Illescas).
- Elaboración de Resolución de creación del Consejo Asesor.
2. FIRMA DE ACTA ACUERDO CON EL MINISTERIO DE SALUD DE LA PROVINCIA SELECCIONADA
- Reunión de presentación del proyecto con el Ministro de Salud de la Provincia seleccionada.
- Reunión de presentación del proyecto con directores provinciales y jefes de servicio involucrados en la implementación del proyecto.
- Elaboración de Acta Acuerdo: definición de compromisos del Ministerio de Salud de la Nación y del Ministerio de Salud de la Provincia.
- Firma de Acta Acuerdo.
3. REORGANIZACION DE LA RED DE LABORATORIOS DE CITOLOGIA DE LA PROVINCIA
- Reacondicionamiento del laboratorio de citología del Hospital Soria para el almacenamiento de las muestras citológicas de las mujeres entre 30 y 65 años (en el marco de la estrategia de doble toma -Prueba de HPV/citología-).
4. INSTALACION DEL LABORATORIO DE HPV EN EL HOSPITAL DE MAYOR COMPLEJIDAD DE LA PROVINCIA
- Creación de un espacio físico para su funcionamiento (requerimientos de espacio, teléfono, refrigeración y equipamiento).
- Montaje del laboratorio de HPV (instalación de equipos).
- Elaboración de guías y normas de procedimiento para el laboratorio y su articulación con el laboratorio de citología del Hospital.
- Designación y contratación del personal a cargo del laboratorio: Jefe de laboratorio, técnico de laboratorio, administrativo (a cargo del Ministerio de Salud Provincial).
- Capacitación del personal que estará a cargo del laboratorio: provista por Qiagen en Brasil (incluye vuelo, hotel, comida y transporte).
5. ARMADO DE LA RED DE REFERENCIA, DEFINICION DE SISTEMAS DE TRANSPORTE DE LAS MUESTRAS.
- Diseño de la red de referencia.
- Definición e implementación de sistemas de transporte de muestras.
6. DISEÑO DEL PROTOCOLO DE TOMA, LECTURA, SEGUIMIENTO Y TRATAMIENTO DE MUJERES TAMIZADAS
- Armado de protocolo de toma, seguimiento y tratamiento.
- Elaboración de manuales y guías para los equipos de salud.
7. TOMA DE MUESTRAS
- Definición de efectores y personal a cargo de la toma.
- Capacitación de los efectores a cargo de la toma sobre la toma de la muestra en un contexto de tamizaje basado en la prueba de HPV-HC2.
8. SISTEMA DE INFORMACION PARA EL MONITOREO Y EVALUACION
- Contratación del informático a cargo del SITAM para el diseño del nodo Laboratorio de HPV.
- Capacitación a usuarios del SITAM.
9. INVESTIGACION FORMATIVA PARA INDAGAR CONOCIMIENTOS Y PERCEPCIONES DE LA POBLACION SOBRE EL HPV (Grupos focales; Entrevistas cualitativas a equipos de salud)
- Contratación de investigadores.
- Realización de investigación cualitativa
- Análisis de resultados y preparación de informe.
10. ELABORACION DE MATERIALES EDUCATIVOS PARA LA POBLACION SOBRE EL TAMIZAJE BASADO EN LA PRUEBA DE HPV (folletos, afiches, spots radiales y televisivos)
- Diseño de materiales.
- Impresión/grabación.
- Difusión en los medios.
11. ELABORACION DE UNA ESTRATEGIA DE COMUNICACION EN MEDIOS
12. FORMACION DE RECURSOS HUMANOS
- Seminario sobre Epidemiología del HPV y cáncer de cuello de útero, y evidencia científica sobre estrategias de tamizaje basadas en la prueba de HPV-HC2:
Destinatarios: profesionales de la salud de la provincia: APS, servicios de ginecología, servicios de patología cervical, servicios de anatomía patológica, oncología.
Duración: 3-4 días.
Fecha: Semana del 16 de mayo 2011.
Financiamiento: Ministerio de Salud de la Nación/organismos internacionales.
Se ha solicitado apoyo a la UICC para el financiamiento de los invitados internacionales (Dr. Eduardo Lazcano-Ponce - México; Dr. Rolando Herrero - Costa Rica; Dr. R Rengaswamy Sankaranarayanan - Francia).
- Taller de capacitación a los equipos de APS.
- Taller de actualización en la técnica de la Colposcopía para servicios de ginecología.
- Capacitaciones específicas
13. LANZAMIENTO DE PROMOCION, TAMIZAJE, SEGUIMIENTO Y TRATAMIENTO
- Búsqueda activa de mujeres en edad objetivo para la realización de la prueba de HPV
- Tamizaje de las mujeres en edad objetivo
- Implementación del protocolo de seguimiento y tratamiento establecido
14. VISITAS DE MONITOREO A LA PROVINCIA
15. IMPLEMENTACION DE UN SISTEMA DE CONTROLES NEGATIVOS DE LA PRUEBA DE HPV
- Diseño e implementación del sistema de controles negativos.
16. EVALUACION DE LA EFICACIA DE LA PRUEBA DE HPV-CH2 PARA DETECTAR hsIL Y CANCER
- Diseño e implementación del estudio.
17. EVALUAR LA ACEPTABILIDAD Y LA EFICACIA DE LA AUTOTOMA DE LA PRUEBA DE HPVHC2 COMO ESTRATEGIA PARA ASEGURAR LA COBERTURA DEL TAMIZAJE
- Diseño e implementación de la evaluación.
18. IMPLEMENTACION DE UN ALGORITMO ALTERNATIVO DE SEGUIMIENTO PARA LAS MUJERES CON PRUEBA DE HPV POSITIVA Y CITOLOGIA NEGATIVA
- Diseño e implementación del estudio
*Cálculo de población estimada a tamizar en la Provincia de Jujuy
Total mujeres entre 30 y 64 años sin obra social: 70.000
Cobertura estimada: 80%
Total mujeres a tamizar para alcanzar meta de cobertura en 3 años: 56,000
Total mujeres a tamizar por año: 20.000
Cantidad esperada de mujeres con HPV positivo: 1800 (9%)
Cantidad esperada de mujeres con HPV positivo y Pap negativo: 1400
Cantidad esperada de mujeres con HPV positivo y Pap positivo: 400 (2% del total mujeres)
Cantidad esperada de mujeres con HPV positivo y Pap positivo pero ASCUS o Bajo Grado: 229 mujeres
Cantidad esperada de mujeres con HPV positivo y HSIL +: 171 (43% de mujeres con HPV positivo y Pap positivo). Estas son las mujeres que luego de la confirmación histológica deberán ser tratadas.
Cantidad esperada de mujeres a seguir el año siguiente con repetición de la prueba de HPVHC2 y Pap: 1629.
Proporción esperada de mujeres con persistencia de HPV+: 40%, 650 mujeres a las que deberá hacerse una colposcopía y biopsia. De estas mujeres, se espera que un 15% tengan hsIL+, es decir, aproximadamente 100 mujeres que deberán tratarse en el año 2 y 3. En total, en el año 2, deberán tratarse 271 mujeres con hsIL+.
Fuente: Lazcano-Ponce et al, 2010.
CRONOGRAMA DE ACTIVIDADES PARA EL PRIMER AÑO
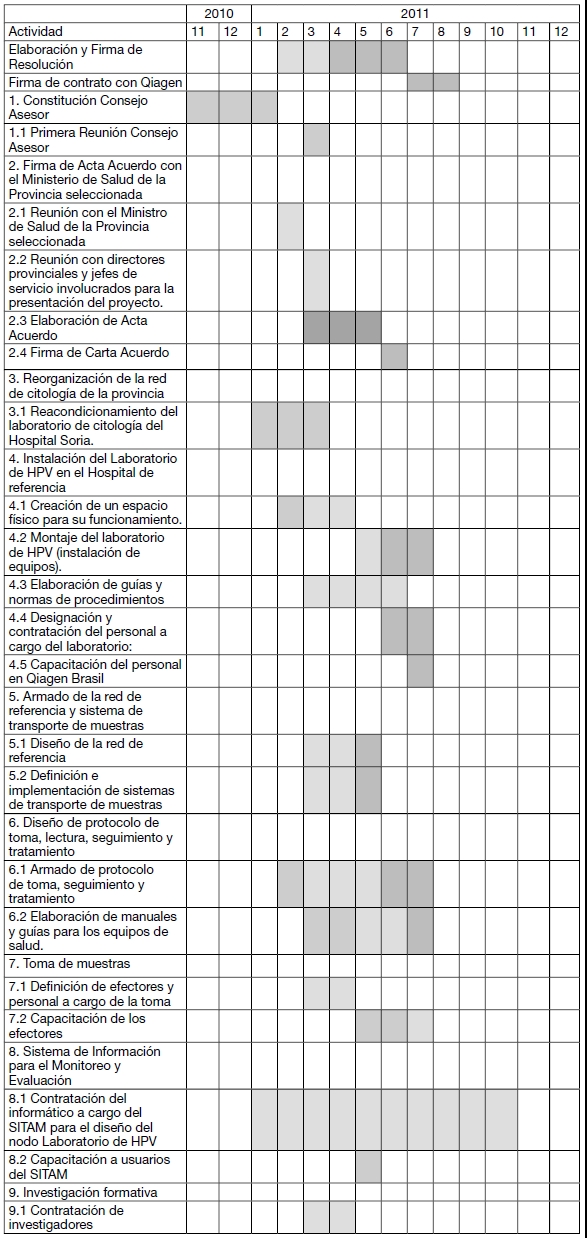
PRESUPUESTO ESTIMADO
ANEXO II. Equipamiento a transferir a la provincia de Jujuy


|